¿Qué es el pH?
El pH es un valor determinado basado en una escala definida, similar a la temperatura. Esto significa que el pH del agua no es un parámetro físico que pueda medirse como una concentración o en una cantidad. En cambio, es una cifra entre 0 y 14 que define cuán ácida o básica es un cuerpo de agua a lo largo de una escala logarítmica ¹. Cuanto menor es el número, más ácida es el agua. Cuanto mayor es el número, más básico es. Un pH de 7 se considera neutral. La escala logarítmica significa que cada número por debajo de 7 es 10 veces más ácido que el número anterior en la cuenta regresiva. Del mismo modo, cuando se cuenta por encima de 7, cada número es 10 veces más básico que el número anterior ².
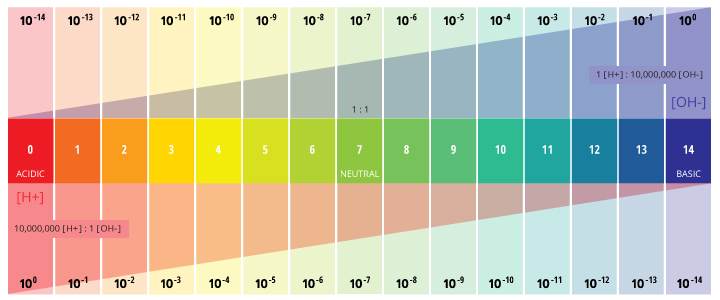
El pH representa el «poder del hidrógeno» ³. El valor numérico del pH está determinado por la concentración molar de iones de hidrógeno (H +) ³. Esto se hace tomando el logaritmo negativo de la concentración de H + (-log (H +)). Por ejemplo, si una solución tiene una concentración de H + de 10 -3 M, el pH de la solución será -log ( 10-3 ), lo que equivale a 3.
Esta determinación se debe al efecto de los iones de hidrógeno (H +) y los iones hidroxilo (OH-) sobre el pH. Cuanto mayor es la concentración de H +, menor es el pH y mayor es la concentración de OH-, mayor es el pH. A un pH neutro de 7 (agua pura), la concentración tanto de iones H + como de iones OH- es de 10⁻⁷ M. Por lo tanto, los iones H + y OH- siempre están emparejados, a medida que aumenta la concentración de uno, el otro disminuirá; independientemente del pH, la suma de los iones siempre será igual a 10⁻¹⁴ M ². Debido a esta influencia, H + y OH- están relacionados con las definiciones básicas de ácidos y bases.
Ácidos y bases
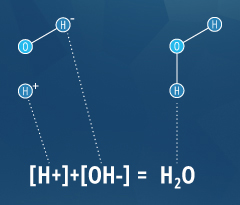
Como definición operativa, un ácido es una sustancia que disminuirá el pH cuando se agrega al agua pura. De la misma manera, una base es una sustancia que aumentará el pH del agua ⁴. Para definir mejor estas sustancias, Arrhenius determinó en 1884 que un ácido liberará un ion de hidrógeno (H +) a medida que se disuelve en agua, y una base liberará un ion hidroxilo (OH-) en agua ⁴. Sin embargo, hay algunas sustancias que se ajustan a la definición operativa (alteración del pH), sin ajustar la definición de Arrhenius (liberación de un ion). Para dar cuenta de esto, Bronsted y Lowry redefinieron ácidos y bases; un ácido libera un ión de hidrógeno o un protón (equivalente a H +) y una base acepta un ión de hidrógeno o un protón ⁴. Esto significa que los ácidos y las bases pueden cancelarse entre sí, como se muestra en la ecuación del agua a la derecha.
Básico o Alcalino
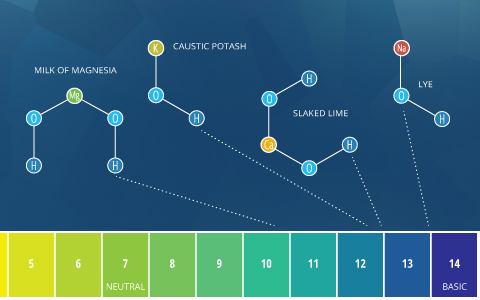
Los términos «alcalino» y «básico» significan aproximadamente lo mismo. Según la definición de Bronsted-Lowry, basic describe cualquier sustancia que reduce la concentración de iones de hidrógeno y aumenta el pH del agua, o en otras palabras, una base ⁴. Alcalino proviene de álcali, que se refiere a compuestos iónicos (sales) que contienen elementos de metales alcalinos o alcalinotérreos que forman iones de hidróxido cuando se disuelven en agua ⁵. Las sales alcalinas son muy comunes y se disuelven fácilmente. Debido a los iones de hidróxido que producen (que aumentan el pH), todos los álcalis son bases. Algunas fuentes definen cualquier base soluble como un álcali ⁵. Como tal, las bases solubles se pueden describir como «básicas» o «alcalinas». Sin embargo, las bases insolubles (como el óxido de cobre) solo deben describirse como básicas, no alcalinas.
La alcalinidad y el pH del agua.
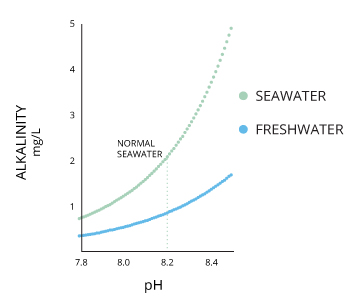
La alcalinidad no se refiere a los álcalis como lo hace el alcalino ⁶. Si bien la alcalinidad y el pH están estrechamente relacionados, existen diferencias claras. La alcalinidad del agua o una solución es la capacidad cuantitativa de esa solución para amortiguar o neutralizar un ácido. En otras palabras, la alcalinidad es una medida de la capacidad del agua para resistir los cambios en el pH. Este término se usa indistintamente con capacidad de neutralización de ácido (ANC) ⁷. Si un cuerpo de agua tiene una alta alcalinidad, puede limitar los cambios de pH debido a la lluvia ácida, la contaminación u otros factores ⁸. La alcalinidad de una corriente u otro cuerpo de agua aumenta con los suelos ricos en carbonatos (carbonatos y bicarbonatos) como la piedra caliza, y disminuye con el flujo de aguas residuales y la respiración aeróbica. Debido a la presencia de carbonatos, la alcalinidad está más estrechamente relacionada con la dureza que con el pH (aunque todavía existen diferencias claras). Sin embargo, los cambios en el pH también pueden afectar los niveles de alcalinidad (a medida que el pH disminuye, la capacidad de amortiguación del agua también disminuye) ⁶. El pH y la alcalinidad están directamente relacionados cuando el agua está al 100% de saturación de aire ⁹.
La alcalinidad del agua también juega un papel importante en los niveles diarios de pH. El proceso de fotosíntesis de algas y plantas utiliza hidrógeno, lo que aumenta los niveles de pH ¹⁰. Del mismo modo, la respiración y la descomposición pueden disminuir los niveles de pH. La mayoría de los cuerpos de agua pueden amortiguar estos cambios debido a su alcalinidad, por lo que las fluctuaciones pequeñas o localizadas se modifican rápidamente y pueden ser difíciles de detectar ¹⁰.
Unidades de pH y alcalinidad
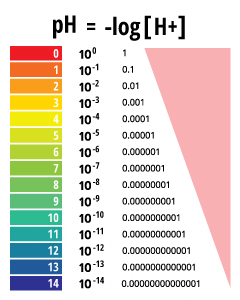
Los valores de pH se informan como un número entre 0 y 14 como una unidad de pH estándar. Esta unidad es equivalente al logaritmo negativo de la concentración molar de iones de hidrógeno (-log (H +)) en la solución. Dependiendo de la precisión de la medición, el valor de pH puede llevarse a cabo con uno o dos decimales.
Sin embargo, debido a que la escala de pH es logarítmica, intentar promediar dos valores de pH sería matemáticamente incorrecto. Si se requiere un valor promedio, se puede informar como una mediana o un rango, no como un simple cálculo ¹⁰.
La alcalinidad se puede informar como mg / L o microequivalentes por litro (meq / L). Cuando está en mg / L, se refiere a las concentraciones de carbonato (CO3 2- ), bicarbonato (HCO3 – ) o carbonato de calcio (CaCO3), aunque el carbonato de calcio es más común ¹¹.
1 mg / L de alcalinidad como CaCO3 = 0.01998 meg / L de alcalinidad
1 mg / L de alcalinidad como CaCO3 = 0.5995 mg / L de alcalinidad como CO3 2-
1 mg / L de alcalinidad como CaCO3 = 1.2192 mg / L de alcalinidad como HCO3 –
¿Por qué es importante el pH?
Si el pH del agua es demasiado alto o demasiado bajo, los organismos acuáticos que viven en él morirán. El pH también puede afectar la solubilidad y la toxicidad de los químicos y metales pesados en el agua ²². La mayoría de las criaturas acuáticas prefieren un rango de pH de 6.5-9.0, aunque algunas pueden vivir en agua con niveles de pH fuera de este rango.
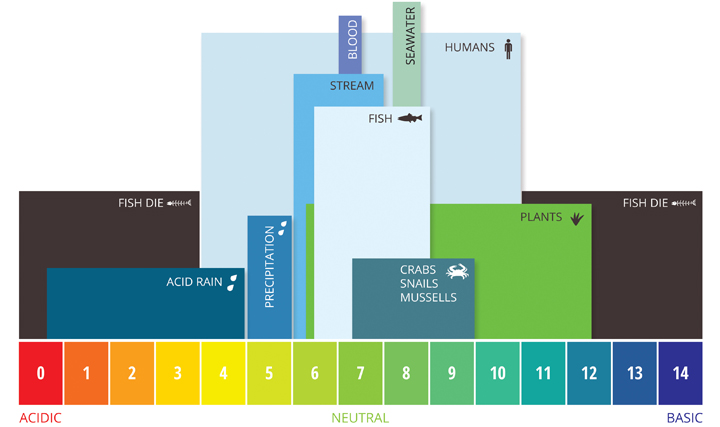
A medida que los niveles de pH se alejan de este rango (hacia arriba o hacia abajo), puede estresar los sistemas animales y reducir las tasas de eclosión y supervivencia. Cuanto más fuera del rango de pH óptimo sea un valor, mayores serán las tasas de mortalidad. Cuanto más sensible es una especie, más se ve afectada por los cambios en el pH. Además de los efectos biológicos, los niveles extremos de pH generalmente aumentan la solubilidad de los elementos y compuestos, lo que hace que los productos químicos tóxicos sean más «móviles» y aumenta el riesgo de absorción por la vida acuática ¹³.
Las especies acuáticas no son las únicas afectadas por el pH. Si bien los humanos tienen una mayor tolerancia a los niveles de pH (los niveles de bebida varían de 4 a 11 con una irritación gastrointestinal mínima), todavía existen preocupaciones ¹⁴. Los valores de pH superiores a 11 pueden causar irritaciones en la piel y los ojos, al igual que un pH por debajo de 4. Un valor de pH por debajo de 2.5 causará daños irreversibles en los revestimientos de la piel y los órganos ¹⁴. Los niveles de pH más bajos aumentan el riesgo de metales tóxicos movilizados que pueden ser absorbidos, incluso por humanos, y los niveles superiores a 8.0 no pueden desinfectarse efectivamente con cloro, causando otros riesgos indirectos ¹⁴. Además, los niveles de pH fuera de 6.5-9.5 pueden dañar y corroer las tuberías y otros sistemas, aumentando aún más la toxicidad de metales pesados.
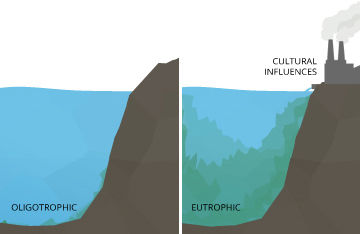
Incluso pequeños cambios de pH pueden tener efectos a largo plazo. Un ligero cambio en el pH del agua puede aumentar la solubilidad del fósforo y otros nutrientes, haciéndolos más accesibles para el crecimiento de las plantas ¹⁰. En un lago oligotrófico, o un lago bajo en nutrientes para plantas y alto en niveles de oxígeno disuelto, esto puede causar una reacción en cadena. Con nutrientes más accesibles, las plantas acuáticas y las algas prosperan, aumentando la demanda de oxígeno disuelto. Esto crea un lago eutrófico, rico en nutrientes y vida vegetal pero bajo en concentraciones de oxígeno disuelto. En un lago eutrófico, otros organismos que viven en el agua se estresarán, incluso si los niveles de pH permanecen dentro del rango óptimo.
Factores que influyen en el pH del agua
Hay muchos factores que pueden afectar el pH en el agua, tanto naturales como artificiales. La mayoría de los cambios naturales ocurren debido a las interacciones con la roca circundante (particularmente las formas de carbonato) y otros materiales. El pH también puede fluctuar con la precipitación (especialmente lluvia ácida) y las aguas residuales o descargas mineras ¹³. Además, las concentraciones de CO2 pueden influir en los niveles de pH.
Dióxido de carbono y pH
El dióxido de carbono es la causa más común de acidez en el agua ¹⁵. La fotosíntesis, la respiración y la descomposición contribuyen a las fluctuaciones de pH debido a sus influencias en los niveles de CO2. La extremidad de estos cambios depende de la alcalinidad del agua, pero a menudo hay variaciones diurnas (diarias) notables ¹⁶. Esta influencia es más medible en cuerpos de agua con altas tasas de respiración y descomposición.
Si bien el dióxido de carbono existe en el agua en un estado disuelto (como el oxígeno), también puede reaccionar con el agua para formar ácido carbónico:
CO2 + H2O <=> H2CO3
H2CO3 puede perder uno o ambos iones de hidrógeno:
H2CO3 <=> HCO3 – + H +…. HCO3 – <=> CO3 2- + H +
Los iones de hidrógeno liberados disminuyen el pH del agua¹⁵. Sin embargo, esta ecuación puede operar en ambas direcciones dependiendo del nivel de pH actual, trabajando como su propio sistema de amortiguación. A un pH más alto, este sistema de bicarbonato se desplazará hacia la izquierda y el CO3 2- recogerá un ion de hidrógeno libre.
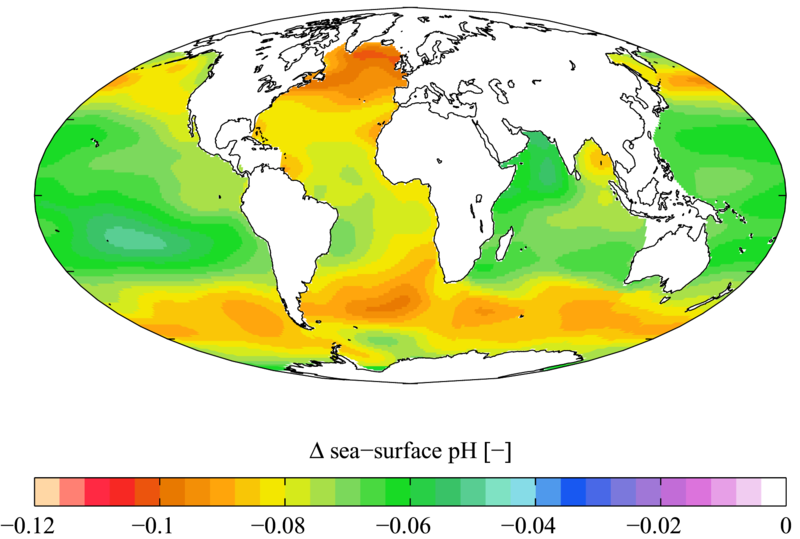
Esta reacción suele ser mínima, ya que el H2CO3 tiene una constante de baja solubilidad (Ley de Henry) ¹⁵. Sin embargo, a medida que los niveles de CO2 aumentan en todo el mundo, la cantidad de CO2 disuelto también aumenta, y la ecuación se llevará a cabo de izquierda a derecha. Esto aumenta el H2CO3, lo que disminuye el pH. El efecto se hace más evidente en los estudios de pH oceánico con el tiempo.
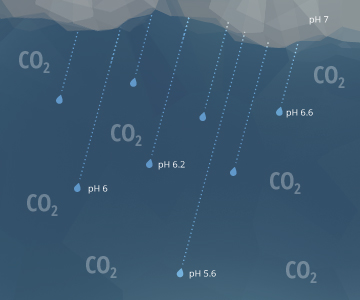
Las ecuaciones anteriores también explican por qué la lluvia tiene un pH de aproximadamente 5,65 ¹⁵. A medida que las gotas de lluvia caen por el aire, interactúan con las moléculas de dióxido de carbono en la atmósfera. Esto crea H2CO3 en las gotas de lluvia, reduciendo el valor de pH de la lluvia ¹⁷. Un nivel de pH de 5.65, aunque ácido, no se considera lluvia ácida. Se espera que la lluvia o nieve natural no contaminada tenga niveles de pH cercanos a 5.6, suponiendo una concentración de CO2 atmosférico estándar de 0.0355% ¹⁵. La lluvia ácida requiere un pH por debajo de 5.0 ²¹.
5.65 es también el pH del agua que se ha equilibrado con el aire y no ha entrado en contacto con materiales de carbonato o piedra caliza.
Influencias naturales del pH
Los materiales de carbonato y la piedra caliza son dos elementos que pueden amortiguar los cambios de pH en el agua. El carbonato de calcio (CaCO3) y otros bicarbonatos se pueden combinar con iones de hidrógeno o hidroxilo para neutralizar el pH¹⁸. Cuando los minerales de carbonato están presentes en el suelo, la capacidad de amortiguación (alcalinidad) del agua aumenta, manteniendo el pH del agua cerca de neutral incluso cuando se agregan ácidos o bases. Los materiales de carbonato adicionales más allá de esto pueden hacer que el agua neutra sea un poco básica.


Como se mencionó anteriormente, la lluvia no contaminada es ligeramente ácida (pH de 5.6). El pH de la lluvia también se puede reducir debido a la ceniza volcánica, las bacterias reductoras de sulfato en los humedales, las partículas en el aire de los incendios forestales e incluso los rayos ¹⁹. Si la lluvia cae sobre una fuente de agua mal amortiguada, puede disminuir el pH del agua cercana a través de la escorrentía.

Las agujas de pino o abeto también pueden disminuir el pH del suelo y el agua que lo atraviesa, ya que se descomponen ¹⁸. La fotosíntesis intensa aumenta el pH del agua ya que elimina el CO2, aunque este cambio suele ser diurno ²⁰.
Influenciadores de pH artificiales
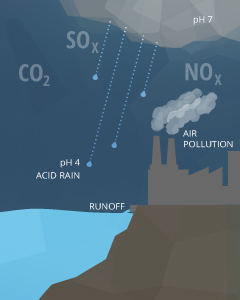
Las causas antropogénicas de las fluctuaciones de pH generalmente están relacionadas con la contaminación. La lluvia ácida es uno de los ejemplos más conocidos de la influencia humana en el pH del agua. Cualquier forma de precipitación con un nivel de pH inferior a 5.0 se conoce como lluvia ácida ²¹. Esta precipitación proviene de la reacción del agua con óxidos de nitrógeno, óxidos de azufre y otros compuestos ácidos, reduciendo su pH ya ligeramente ácido. Estas emisiones generalmente provienen de operaciones de minería y fundición o de la combustión de combustibles fósiles (quema de carbón y automóviles) ¹⁸. Los niveles extremadamente altos de CO2 también pueden disminuir aún más el pH de la lluvia ¹⁷.
La contaminación de origen puntual es una causa común que puede aumentar o disminuir el pH dependiendo de los químicos involucrados ¹⁸. Estos productos químicos pueden provenir de la escorrentía agrícola, la descarga de aguas residuales o la escorrentía industrial. Las operaciones mineras (particularmente el carbón) producen escorrentía ácida y filtración de agua subterránea ácida si el suelo circundante está pobremente protegido ²². La descarga de aguas residuales que contiene detergentes y productos a base de jabón puede hacer que una fuente de agua sea demasiado básica.
Niveles de pH típicos
Los niveles típicos de pH varían debido a las influencias ambientales, particularmente la alcalinidad. La alcalinidad del agua varía debido a la presencia de sales disueltas y carbonatos, así como a la composición mineral del suelo circundante. En general, cuanto mayor es la alcalinidad, mayor es el pH; cuanto menor es la alcalinidad, menor es el pH ⁶. El rango de pH recomendado para la mayoría de los peces es entre 6.0 y 9.0 con una alcalinidad mínima de 20 mg / L, con niveles ideales de CaCO3 entre 75 y 200 mg / L ²⁰.
Los organismos oceánicos como el pez payaso y el coral requieren niveles de pH más altos. Los niveles de pH inferiores a 7.6 causarán que los arrecifes de coral comiencen a colapsar debido a la falta de carbonato de calcio ³⁹. Las especies sensibles de agua dulce, como el salmón, prefieren niveles de pH entre 7.0 y 8.0, se angustian gravemente y sufren daños fisiológicos debido a la absorción de metales a niveles inferiores a 6.0 6.0.
Consideraciones ambientales
La precipitación natural, tanto de lluvia como de nieve, tiene un pH cercano a 5.6 debido al contacto con CO2 y otras influencias atmosféricas. La mayoría de los pastos y legumbres prefieren suelos con un pH de 4.5-7.0, por lo que la ligera acidez de la lluvia puede beneficiar a los suelos con carbonato ²³.
La acidez del ambiente circundante también puede afectar el pH del agua. Esto es más obvio cerca de las áreas mineras, pero el efecto también puede ocurrir naturalmente. La escorrentía ácida agota la alcalinidad del agua y reduce el pH por debajo de los niveles óptimos. Esto puede ser tolerable para algunas especies acuáticas (como las ranas) pero no para la mayoría de los peces. Algunas ranas y otros anfibios a menudo pueden tolerar niveles de pH tan bajos como 4.0 ²⁴. Los suelos ácidos en el Amazonas provocan que muchos de los lagos y ríos tengan naturalmente valores bajos de pH ³⁸. Debido a las sustancias húmicas disueltas de la escorrentía y la absorción, las fuentes de «aguas negras» pueden tener un pH tan bajo como 4,43. Las fuentes de “agua clara” tendrán un valor de pH ³⁸ ligeramente más alto, pero aún ácido. Es por eso que el pez ángel y el disco de la cuenca del río Amazonas pueden prosperar muy felizmente en aguas con un pH tan bajo como 5.0 ²⁵.
El agua de mar tiene un pH de alrededor de 8.2, aunque puede variar entre 7.5 y 8.5 dependiendo de su salinidad local. Los niveles de pH aumentarán con la salinidad hasta que el agua alcance la saturación de carbonato de calcio (CaCO3) ¹⁶. Los océanos generalmente tienen una alcalinidad más alta debido al contenido de carbonato y, por lo tanto, tienen una mayor capacidad para amortiguar iones de hidrógeno libres de ²⁷.
Los lagos, estanques y arroyos de agua dulce generalmente tienen un pH de 6-8, dependiendo del suelo circundante y el lecho de roca ²¹. En lagos más profundos donde se produce la estratificación (estratificación), el pH del agua es generalmente más alto (7.5-8.5) cerca de la superficie y más bajo (6.5-7.5) a mayores profundidades ¹⁰. Algunos estados, como Alaska, están intentando mantener un estándar de pH para la calidad del agua. El Estándar de Calidad del Agua de Alaska requiere niveles de pH entre 6.5 y 8.5 para proteger a las numerosas poblaciones de salmón en el estado ⁴⁰.
Lagos alcalinos y ácidos
En todo el mundo hay varios lagos con niveles de pH inusuales. Los lagos alcalinos, también conocidos como lagos de soda, generalmente tienen un nivel de pH entre 9 y 12. Esto a menudo se debe a un alto contenido de sal (aunque no todos los lagos de sal tienen un pH alto). Estos lagos tienen altas concentraciones de minerales, particularmente sales disueltas: sodio, calcio, carbonatos de magnesio y bicarbonatos ²⁸. Dependiendo del lago, también pueden estar presentes boratos, sulfatos y otros elementos (generalmente iones base fuertes) ²⁹. Los lagos alcalinos se forman cuando la única salida de agua es la evaporación, dejando que los minerales acumulen ³⁰. Estos minerales a menudo forman columnas de depósitos minerales, conocidos como columnas de toba. Muchos lagos alcalinos son un recurso comercial para las cenizas de soda y la potasa,


Un ejemplo notorio de un lago alcalino es el lago Natron en Tanzania. El lago Natron tiene un pH de hasta 10,5 debido a las altas concentraciones de decahidrato de carbonato de sodio (carbonato de sodio) y bicarbonato de sodio (bicarbonato de sodio) que ingresa al agua desde el suelo circundante ³¹. Mientras que el lago es compatible con un ecosistema próspero, que incluye flamencos, tilapia alcalina y algas resistentes al pH, Nick Brant, un fotógrafo, ha creado muchas imágenes inquietantes de animales que murieron en este lago ³¹. Los cuerpos de estos animales son preservados por el carbonato de sodio, al igual que el antiguo proceso de momificación egipcio.
Los lagos ácidos generalmente se desarrollan cerca de los volcanes, donde el ácido sulfúrico, el sulfuro de hidrógeno, el ácido fluorhídrico, el ácido clorhídrico y el dióxido de carbono pueden filtrarse al agua ³². En áreas no volcánicas, los lagos ácidos también pueden desarrollarse después de la deposición ácida de eventos tales como lluvia ácida, contaminación o escorrentía ácida de las operaciones mineras ³³. Al igual que sus equivalentes alcalinos, los lagos ácidos no tienen salida, excepto la evaporación, que concentra los sulfatos y ácidos. Los ácidos pueden ingresar al agua a través de la difusión atmosférica por la quema de carbón, lluvia ácida o después de una erupción. En los lagos volcánicos, los ácidos pueden ingresar al agua a través de una fumarola activa o ventilación volcánica.
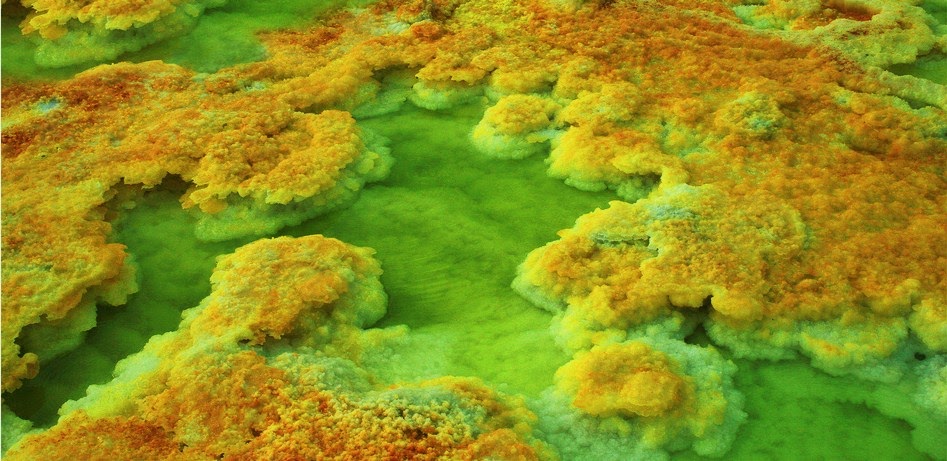
Los lagos ácidos en Dallol en Etiopía son el resultado de la lixiviación ácida de los volcanes cercanos. El azufre y el hierro en el agua dejan depósitos amarillos y de color óxido alrededor del borde del agua.
Con un nivel de pH inferior a 5.0, pocos organismos pueden vivir en lagos ácidos. Sin embargo, hay una excepción notable: la danza Osorezan, o danza japonesa. Este pez prospera en las aguas ácidas del lago Osorezan, descansa cómodamente a un pH de 3.5 y nada en aguas de pH neutro solo para desovar ³⁴.
Acidificación oceánica
La acidificación del océano es causada por una afluencia de dióxido de carbono disuelto. A medida que los niveles de CO2 atmosférico aumentan debido a causas antropogénicas, el CO2 disuelto también aumenta, lo que a su vez disminuye el pH del agua.
Cuando el agua se satura con CO2, no solo reduce el pH del océano, sino que también agota las fuentes de carbonato de calcio ³⁵. El carbonato de calcio, CaCO3, es un ingrediente necesario en la construcción de corales, conchas y exoesqueletos para muchas criaturas acuáticas. A medida que los niveles de CO3²⁻ disminuyen, se hace más difícil para las criaturas marinas construir sus conchas.
Como se mencionó en la sección «Dióxido de carbono y pH», el CO2 adicional aumenta el número de iones de hidrógeno en el agua, reduciendo el pH:
CO2 + H2O <=> H2CO3… H2CO3 <=> (H +) + HCO3⁻
A niveles de pH entre 6.4 y 10.33, algunos de esos iones de hidrógeno se unen a iones de carbonato ²²:
(H +) + CO3 2- <=> HCO3 –
Así, a medida que aumentan los niveles de CO2, la disponibilidad de carbonato, CO3 2- disminuye, reduciendo la cantidad disponible para la construcción de conchas y corales ³.
CO2 + H2O + CO3²⁻ <=> 2HCO3⁻
 Tratamiento de agua
Tratamiento de agua